Translational Psychiatry
Translational Psychiatry 2025-01-14
2025-01-14 732
732Translational Psychiatry丨应用功能性近红外光谱和机器学习预测重度抑郁症 6 个月后的治疗反应
重度抑郁障碍(major depressive disorder, MDD)是全球最普遍的精神疾病,影响着超过3亿不同年龄和背景的人[1]。目前,MDD 是全球残疾的主要原因之一,预计到 2030 年,它将成为全球疾病负担的主要贡献者 [1、2]。MDD 患者初始抗抑郁治疗的成功率有限,只有 2/3 的患者有反应,这凸显了识别预测性生物标志物的迫切需求 [3]。在 MDD 中,对治疗的反应不足是有据可查的不良长期结局的预测指标。此外,不良的治疗反应会显著降低患者寻求帮助的积极性 [4]。此外,先前的研究发现治疗耐药性与自杀风险增加之间存在显著相关性 [5]。
虽然患者对治疗后 MDD 症状的改善程度差异很大,但据推测存在预测性临床模式 [6、7]。生物标志物作为生物过程或状态的客观指标,可以为个体对 MDD 的易感性及其对特定治疗方式的潜在反应提供有价值的见解 [8]。因此,确定具有临床价值的生物标志物对于增强和加速治疗反应是必要的 [9、10]。具有预测准确性的预后标志物可以通过识别需要额外治疗或联合治疗以更好地针对其首发症状的患者而使这些患者受益 [11]。
目前,神经影像学和机器学习技术的联合利用虽然有限,但具有用于抑郁分类和预测精神障碍抗抑郁反应的潜力 [9、12、13]。与 MDD 患者相比,健康个体在执行认知任务时,额叶和颞叶皮层的反应性更为强烈 [14、15、16、17、18]。以前的研究发现,前扣带回功能活动的增加可靠地预测了临床反应,在 MDD 的额纹状体边缘区域内确定了结构相关性 [11]。目前的研究集中在静息态神经影像学技术上,特别是静息态功能磁共振成像 (rs-fMRI),以评估治疗结果 [10、19]。与任务相关的大脑信号可以揭示对结构或静息态模式可能无法揭示的上下文依赖性神经机制的重要见解 [20、21]。
近日,Translational Psychiatry上发布了一篇关于MDD和功能性近红外技术的文章,名为“Application of functional near-infrared spectroscopy and machine learning to predict treatment resopnse after six months in mmajor depressive disorder”。研究团队通过评估 fNIRS 和临床评估数据使用机器学习技术预测 6 个月内药物治疗反应的预测能力,并探索了哪些大脑区域可能在预测 MDD 的治疗结果方面发挥相对更重要的作用,从而提供对病理学的深入生物学解释。

越来越多的利用神经影像学技术的研究表明,不仅在确定各种精神疾病治疗反应的准确预测因子方面取得了重大进展,而且在确定 MDD 的潜在病理生理机制方面也取得了重大进展 [9]。采用多变量技术的神经影像学分析也成功确定了预测 MDD 治疗反应的神经特征 [22]。在一项涉及 37 名受试者的基于任务的 fMRI 研究中,构建了机器学习模型来预测对安非他酮的反应,曲线下面积 (AUC) 为 0.71,旨在加快治疗选择过程 [23]。在另一项研究中,使用多模态 MRI 和 XGBoost 的临床数据预测对舍曲林的治疗反应,实现了 0.68 的平衡准确度 (bAcc) [10]。相对于 MRI,功能性近红外光谱 (fNIRS) 提供了可扩展性和经济可行性,因此使其成为预测治疗反应的有效辅助工具。虽然 fNIRS 具有诊断 MDD 的潜力,但其预测治疗反应的能力仍未得到充分研究。
研究团队这项为期 6 个月的纵向研究涉及 70 名 MDD 患者。分析 fNIRS 和临床评估数据以确定治疗结果。其次,fNIRS 特征与患者 HAM-D 评分的变化相关。最后,采用了一系列具有嵌套交叉验证的机器学习模型来预测治疗反应。
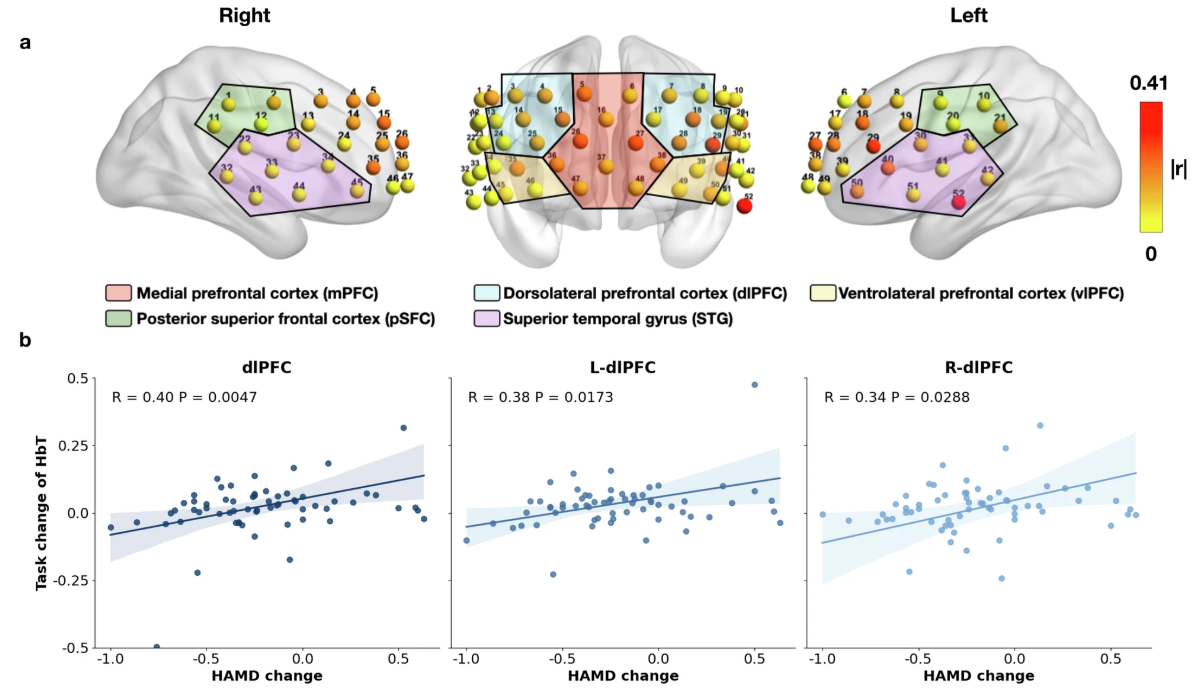
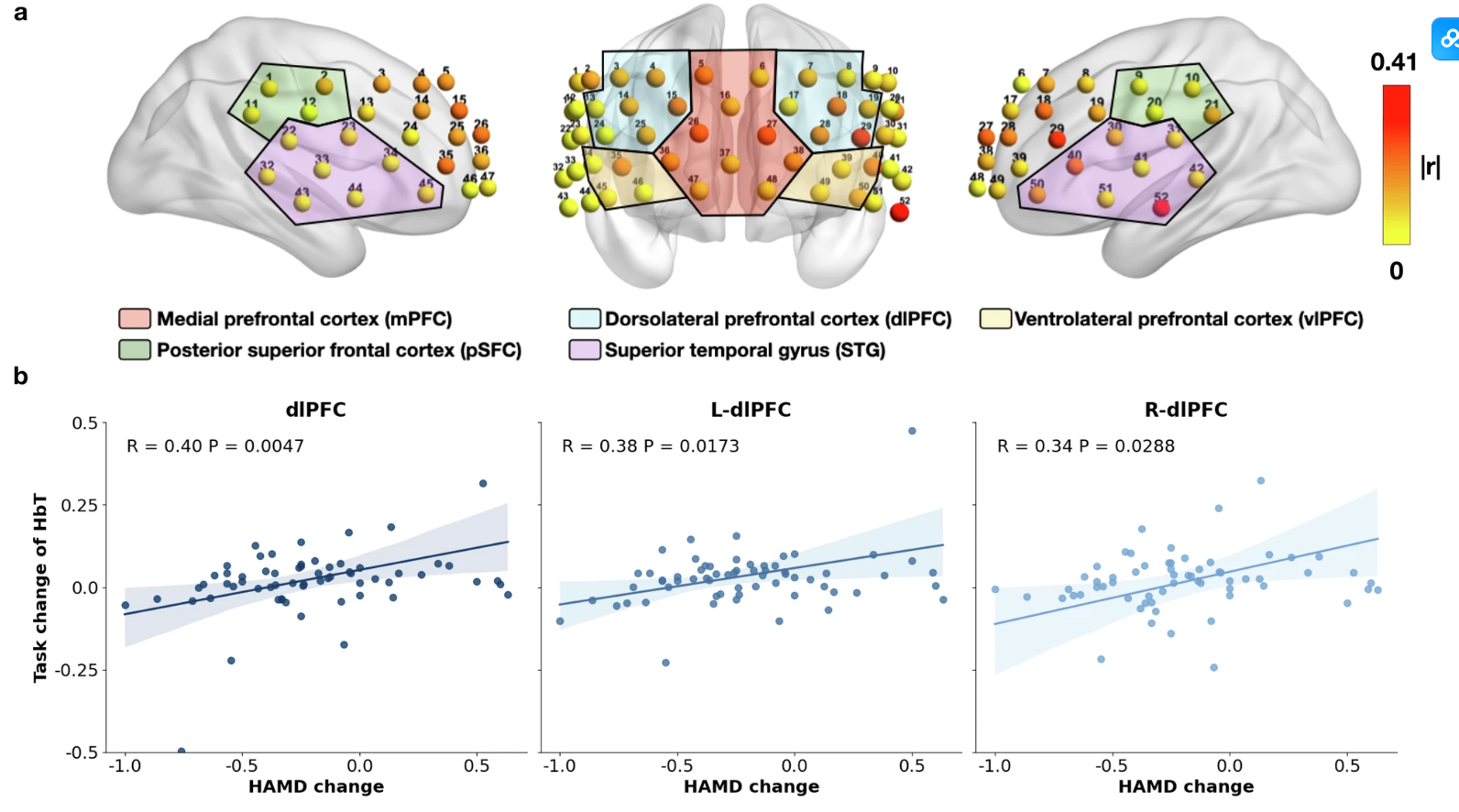
我们的研究发现 HbT 特征的任务变化,定义为平均任务后 HbT 和平均任务前 HbT 之间的差异,与 dlPFC 区域的 HAM-D 变化显着相关。换句话说,如果进行 VFT 后 HbT 的平均浓度恢复到任务前的原始浓度,则 MDD 患者倾向于在 6 个月后对治疗产生积极反应。这一发现可能表明 dlPFC 中 HbT 浓度的恢复能力可能表明 MDD 治疗反应的可能性。然而,尽管任务相关的 fNIRS 信号可以反映血流动力学的恢复能力,但其他个人和社会因素在治疗结果中仍然起着不可忽视的作用。可能导致预测模型无法预测治疗反应的一个因素是基线时间和 6 个月随访评估之间生活事件的发生。这些事件会显著影响精神状态或治疗结果,也可能受到治疗剂量、遗传多态性和生活方式因素变量的影响,如睡眠质量、身体活动和社会关系。
fNIRS 预测可以为患者的治疗反应轨迹提供有价值的见解。除了允许更现实的期望外,当患者知道他们的治疗进展被客观地衡量时,他们更有可能有动力坚持治疗。其次,临床医生可以根据每位患者的 fNIRS 概况简化他们的心理教育工作。例如,预测治疗反应较慢或较差的患者可能受益于有关应对技巧和预防复发的额外教育。第三,fNIRS 概况将通过帮助临床医生确定更有可能引起患者积极反应的治疗方法,从而允许个性化的治疗计划。第四,可以识别预测恢复较慢或不完全的患者,并优先进行更深入的治疗和监测,从而有可能改善治疗结果并优化精神科医疗保健环境中的资源分配。这种方法将 fNIRS 治疗反应预测与机器学习相结合,有可能改善治疗结果,降低与无效治疗相关的医疗保健成本,并最终改善 MDD 患者的生活质量。
承认这项研究的局限性同样重要。首先,样本量相对较小,这是先前的限制,使我们无法进行基于性别的分析;使用更大的数据集来验证我们的方法对于提高我们发现的普遍性是必要的。其次,尽管我们使用了以 LOOCV 作为外部测试循环的嵌套交叉验证,并使用分层的五重交叉验证作为内部验证循环,但来自单独队列的独立测试数据将加强我们的结果。第三,与 MDD 相关的症状范围广泛,使其成为一种高度异质性的疾病,每个患者的症状和治疗反应差异很大 [40],因此使治疗结果的准确预测复杂化。此外,许多患者在基线时已经在服用药物,这可能会使治疗反应的预测复杂化。虽然很理想,但获得初治 MDD 患者的代表性样本是一项重大挑战。最后,治疗计划因患者而异,这增加了预测治疗反应的不确定性和难度。
未来的工作可以在可行的情况下调查患者对标准化治疗方案的反应。随着在更大、更多样化的人群中进行的更多研究的验证,这些发现可以转化为使用计算模型为 MDD 患者制定个体化治疗计划,从而彻底改变临床实践并有助于更好的治疗结果。
参考文献:
[1]World Health Organization (WHO) and others. Depression and other common mental disorders: global health estimates. World Health Organization (WHO) and others, Geneva; 2017.
[2]Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med 2006;3:2011–30.
[3]Trivedi MH, Rush AJ, Wisniewski SR, Nierenberg AA, Warden D, Ritz L, et al. Evaluation of outcomes with citalopram for depression using measurement-based care in STAR*D: implications for clinical practice. Am J Psychiatry. 2006;163:28–40.
[6]Chekroud AM, Zotti RJ, Shehzad Z, Gueorguieva R, Johnson MK, Trivedi MH, et al. Cross-trial prediction of treatment outcome in depression: a machine learning approach. Lancet Psychiatry. 2016;3:243–50.
原文出处:https://www.nature.com/articles/s41398-025-03224-7#Sec10
图片来源网络,如有侵权请及时联系删除!