Cell
Cell 2026-01-29
2026-01-29 72
72Cell|华人学者发现压力诱导的交感神经过度激活会引发毛囊坏死
压力是主要的疾病风险,但压力驱动组织变化的机制才刚刚开始显现。虽然此前的研究主要聚焦于慢循环的干细胞,压力对高度增殖细胞的影响尚不明确——这些细胞通常代谢更活跃且对干扰更敏感。此外,尽管远处的压力事件与当前疾病有关,在这些案例中确定因果关系尤其具有挑战性。因此,急性压力事件是否会留下持久影响仍未确定。
毛囊为研究压力如何影响再生组织提供了可作的模型。压力长期以来与脱发疾病相关:休止期脱发表现为大量脱发,与压力事件密切相关。斑秃由自反应性CD8 T细胞攻击毛囊驱动,这些病例常因压力而出现或复发,且可追溯到多年前的创伤事件。在新冠疫情期间,脱发病例也激增。还有许多其他压力相关的脱发案例未被诊断或未分类。虽然其机制尚不明确,但这些观察表明压力会对毛囊产生即时和长期的影响。
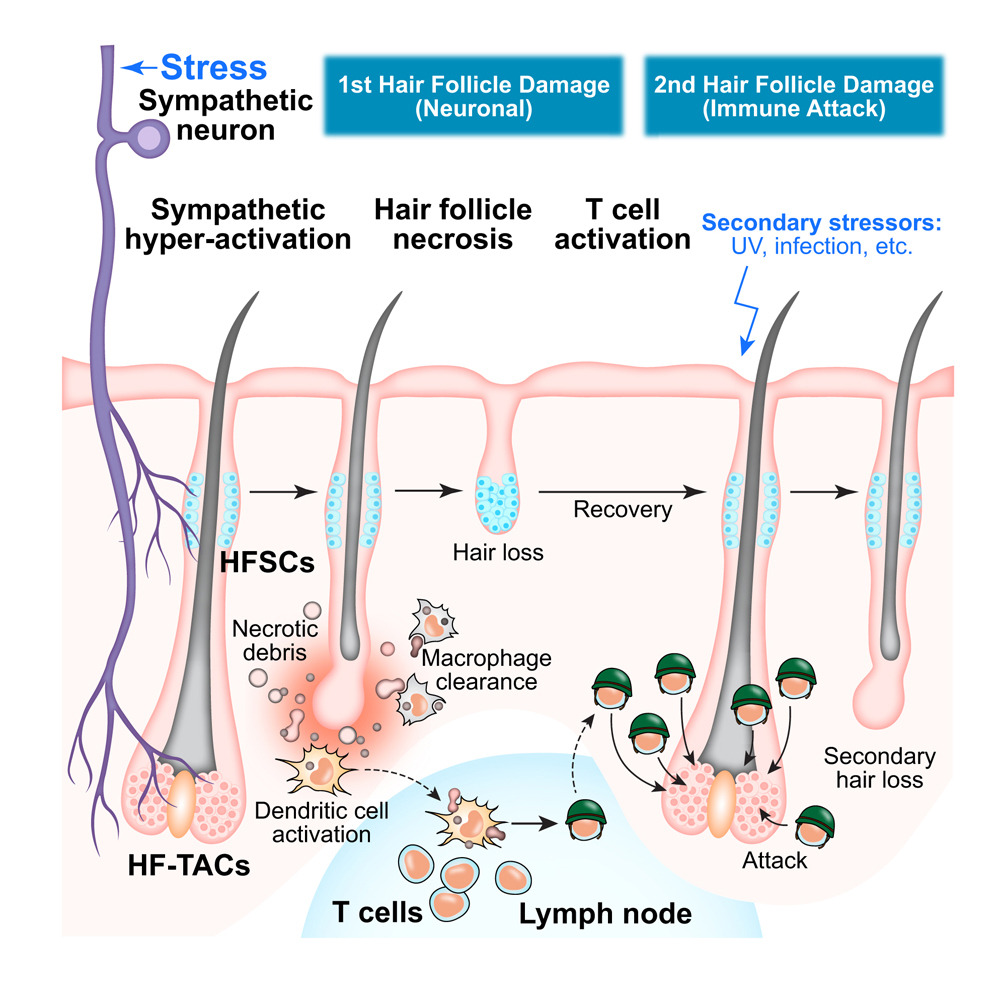
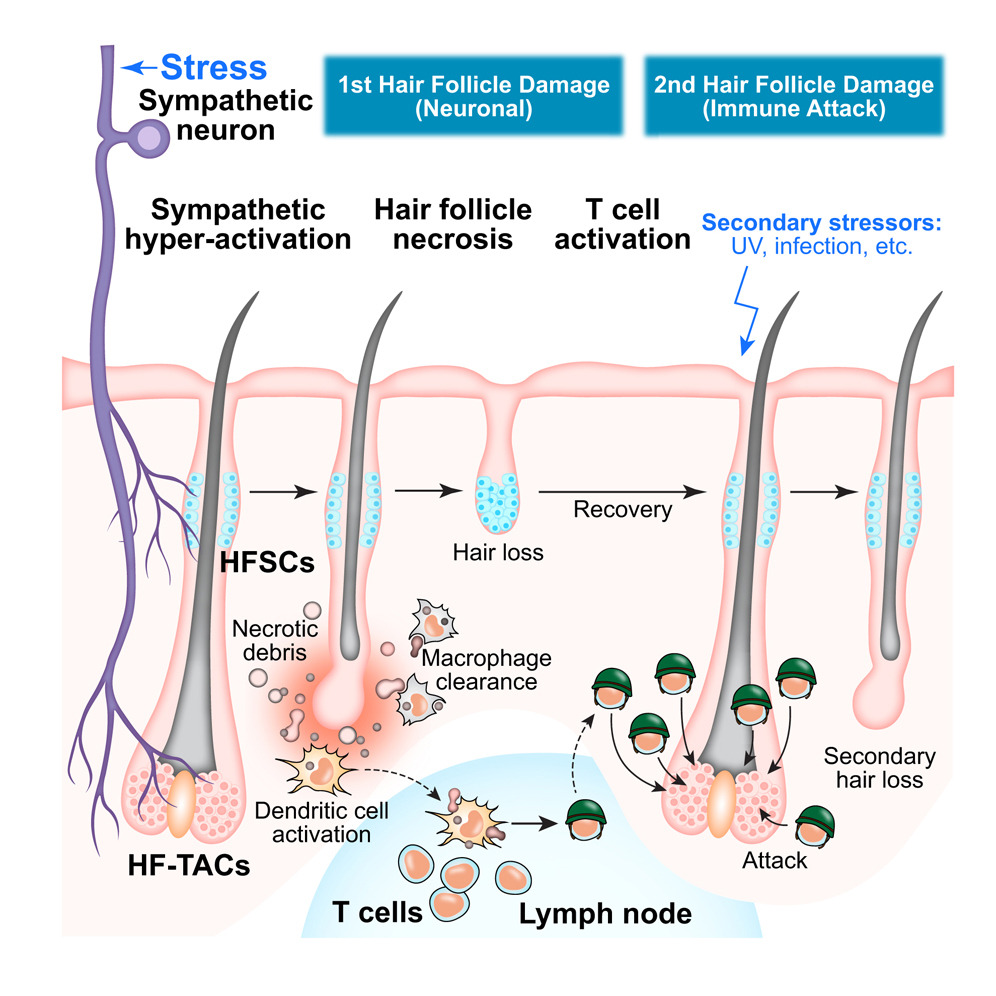
毛囊是一种高度再生的上皮组织,生命周期内经历休眠期(休止期)、生长期(生长期)和退化期(卡塔期)的周期(见图S1A)。在生长期起始时,静止的毛囊干细胞(HFSC)短暂增殖,并产生快速分裂的毛囊转移细胞(HF-TACs)。HF-TAC推动再生毛囊的向下生长,产生向上生长的毛干,最终形成可见的毛发。已知慢性压力通过肾上腺衍生皮质酮升高作用于真皮生态位,维持HFSC的静止期,从而延长休止期。研究表明,急性声应力会加速啮齿动物进入卡塔根。然而,对于大约90%的人类头皮毛囊处于生原中,理解压力如何影响生原毛囊尤为重要。
2025年11月26日,哈佛大学许雅捷团队在Cell上发表题为"Stress-induced sympathetic hyperactivation drives hair follicle necrosis to trigger autoimmunity"的论文,该研究表明急性压力会引发快速脱发并启动自身免疫。揭示了压力如何通过交感神经诱导坏死在高度增殖的HF-TACs中立即造成组织损伤,进而激活能够对同一组织发动未来攻击的自身反应性T细胞。

研究发现,急性应激通过两部分机制损伤同生毛囊:
(1)交感神经激活即时作用,推动HF-TAC坏死,通过去甲肾上腺素;
(2)自身反应性CD8 T细胞因坏死反应而激活,后续炎症损伤时可针对毛囊细胞。
因此,一次急性应激发作可能立即造成伤害,从而使同一组织未来更容易受损。虽然这两种损伤阶段在表型上相似,但它们由不同的过程驱动——一个是神经元,另一个是免疫过程。
交感神经系统在急性压力下会引发快速的生理变化,比如心跳加快和肌肉力量增强以应对战斗或逃跑。发现表明,这种反应可能超越短暂的生理,主动消灭细胞。牺牲代谢成本高但可替代的细胞如HF-TACs,同时保留在威胁解除后能够再生组织的休眠干细胞,这可能是一种战略性妥协,旨在节省有限资源用于关键应激反应。
HFSCs和HF-TAC在压力下的差异结果反映了代谢的差异。HF-TACs高度依赖线粒体代谢——基线时使用氧化磷酸化,压力下尝试转为脂肪酸氧化——这使得它们容易受到破坏线粒体完整性的钙激增影响。相比之下,HFSCAs依赖糖酵解,线粒体无关过程,可能增强其对钙波动的韧性。与此相符的是,细胞内钙的化学发生升高会诱导HF-TACs死亡,但保留HFSCs。尽管ADRB2通常被视为通过环状AMP(cAMP)进行Gs耦合的GPCR信号,但体外研究表明它也可能增加细胞内钙含量,我们的生命体内影像为此提供了体内证据。在稳态和冷刺激下,交感神经元也通过休止期HFSC中的ADRB2信号增强HFSC的活性。
冷暴露会诱导轻度交感神经激活。轻微的交感神经激活很可能支持毛囊生长,而过度激活则损害毛囊。压力诱导的毛囊死亡与断层细胞不同。断节细胞受极其严格控制——凋亡性毛囊细胞被邻近的上皮细胞包围,而不会引发炎症。相比之下,压力会引发HF-TAC坏死——通常始于凋亡,但在强烈压力下损伤迅速积累,可能加剧,无法有时间进行可控的解决。坏死会将细胞碎片和细胞内内容物释放到炎症环境中,并可诱导CD8 T细胞介导的自身免疫。
此外,线粒体功能障碍和破裂——如HF-TAC在异常钙流入后出现的症状——被提出可能引发自身免疫性和自身炎症性疾病。我们展示了压力诱导坏死的残骸结合炎症,促使DC误将坏死毛囊中的自抗原识别为致病体,从而激活和扩展针对毛囊的自反应性CD8 T细胞。尽管压力诱导坏死足以激活能够攻击毛囊的自反应性T细胞,但移植到Rag1时+−/−小鼠是克服外周耐受性并增强野生型小鼠CD8 T细胞介导杀死的第二种炎症性刺激。
这些针对毛球的特异性攻击类似于斑秃,很可能是由毛球内局部初期坏死以及HFSCs免疫特权状态共同作用。同样,斑秃或其他自身免疫疾病患者在炎症诱因后常常会复发。自身免疫的启动仍是最大的谜团之一,源于环境因素与遗传易感性之间复杂的相互作用。尽管压力长期被认为与之有关,但直接证据却很少。
此次研究发现,揭示了一种机制,即强烈的急性应激事件通过激活和扩展在压力诱导坏死后罕见的自身反应性T细胞,从而引发自身免疫。虽然坏死通常与感染或损伤等外部损伤相关,但也表明,在压力下神经活动增强,也可能发生在生理上。
事实上,坏死样细胞死亡,尤其是在小范围内,可能比以往认知更为普遍——由压力、损伤、感染或神经元过度激活触发——这可能成为自身免疫启动的一般机制。一旦被坏死激活,自反应性T细胞即使组织恢复后也可能无法完全恢复到原始状态。虽然调控T细胞(Tregs)通常会抑制自反应性T细胞,在额外的炎症刺激下,它们抑制这些细胞的能力可能变得不足。
此外,一些被激活的自身反应性T细胞可能成为长寿命的记忆T细胞,使其更可能在未来触发因素(如其他压力事件、感染、损伤或紫外线引发炎症)时重新激活,从而增加自身免疫性反复发作的风险。当前T细胞介导自身免疫的小鼠模型——包括基于风险等位基因组合遗传易感的模型(例如,非肥胖糖尿病患者[NOD]),中枢或外周耐受缺陷(如Aire敲除、Ctla4敲除或Treg缺乏),用自身抗原进行免疫,以及自反应性T细胞受体(TCR)转基因小鼠系——在发现自身免疫机制方面发挥了关键作用。我们的研究提出了一种在野生型小鼠中无突变或免疫激活自身免疫的模型。
在这里,压力作为生理触发器,诱导抗原释放,激活自身反应性的CD8 T细胞,同时不引发明显的自身免疫攻击。随后出现的挑战,如感染或紫外线暴露,可能会覆盖外周耐受性,诱发自身免疫病变。这为研究自身免疫如何在健康个体中被启动、控制和重新激活提供了生理相关框架。
总之,研究揭示了压力如何对组织造成急性损伤和长期损伤。这些机制有助于解释斑秃的发病及其与压力的常见关联。更广泛地说,研究发现表明生理和环境因素如何诱发健康个体的自身免疫,这可能与多发性硬化症、1型糖尿病和红斑狼疮等疾病相关,而这些疾病的原因在许多人中仍复杂且神秘。
原文参考:https://www.cell.com/cell/fulltext/S0092-8674(25)01247-4
备注:图片来源网络如有侵权请及时联系删除!